服务热线
86-21-54488867 / 400-0534316
GB/T 23273.1-2009 草酸钴化学分析方法 第1部分: 钴量的测定 电位滴定法
范围
GB/T 23273 的本部分规定了草酸钴中钴量的测定方法。
本部分适用于草酸钴中钴量的测定。测定范围: 30%~33%。
方法提要
试料用稀硝酸分解,在柠檬酸盐氨性溶液中,K3[Fe(CN)6]溶液将钴(Ⅱ)氧化为钴(Ⅲ),过量的K3[Fe(CN)6]采用电位滴定法用钴标准滴定溶液进行返滴定。
仪器
自动电位滴定仪,附搅拌装置。
与仪器匹配的氧化还原复合电极,或指示电极-铂电极,参比电极-钨电极或Ag/AgCl等其他电极。电极的选择遵照厂家指导说明书。
分析步骤
试料
称取1.000g(m)试样,至0.0001g。
测定
将试料置于250mL烧杯中,以少量水润湿。加入20mL硝酸,加热溶解*,取下,冷却。用水洗涤表皿及杯壁,煮沸,取下冷却。移入100mL(V)容量瓶中,以水定容。
分取10.00mL(V3)试液于150mL烧杯中,加入50mL柠檬酸铵氨性混合溶液,加入15.00mL(V2) K3[Fe(CN)6]标准溶液,于自动电位滴定仪上,插入电极,在搅拌下滴加(体积记录为V1)钴标准滴定溶液,按仪器设定的程序,滴定至终点电位。
终点电位的确定
移取15.00mL钴标准滴定溶液于150mL烧杯中,加入50mL柠檬酸铵氨性混合溶液,加入15.00mL K3[Fe(CN)6]标准溶液,于自动电位滴定仪上,插入电极,在搅拌下滴加钴标准滴定溶液,记录加入钴标准滴定溶液的体积和相对应的电位值。当电位下降的变化较大时,减慢钴标准滴定溶液滴加速度,应尽可能每次加入很小的量,继续滴加直至电位变化很小为止。
用加入的钴标准滴定溶液体积为横坐标,对应的电位为纵坐标,绘制滴定曲线,以曲线突跃的中点处为终点电位。至少测定三次。建议在突跃点附近计算其一阶导数,可更地确定终点电位。
具有自动确定终点电位程序的自动电位滴定仪,可根据设定的程序自动滴定至终点。
分析结果的计算
按式(2)计算钴的质量分数ωCo,数值以%表示: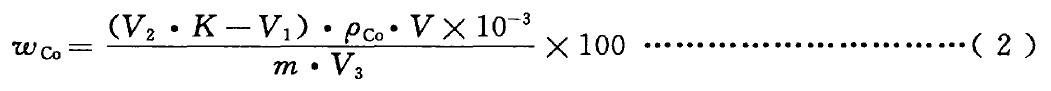
式中:
m 一一试料量,单位为克(g);
ρCo一一钴标准滴定溶液的质量浓度,单位为毫克每毫升(mg/mL);
V 一一试液的总体积,单位为毫升(mL);
V1 一一返滴定所消耗钴标准滴定溶液的体积,单位为毫升(mL);
V2 一一加入K3[Fe(CN)6]标准溶液的体积,单位为毫升(mL);
V3 一一分取试液的体积,单位为毫升(mL);
K 一一滴定系数,单位体积的K3[Fe(CN)6]标准溶液消耗钴标准滴定溶液的体积数。
所得结果表示至小数点后两位。