服务热线
86-21-54488867 / 400-0534316
GB/T 39138.1-2020 金镍铬铁硅硼合金化学分析方法 第1部分: 金含量的测定 硫酸亚铁电位滴定法
范围
GB/T 39138 的本部分规定了金镍铬铁硅硼合金中金含量的测定方法。
本部分适用于金镍铬铁硅硼合金中金含量的测定。 测定范围: 15.00%~30.00%。
方法原理
试料用盐酸和硝酸溶解,在硫酸与磷酸介质中,用硫酸亚铁标准滴定溶液滴定Au(Ⅲ)至Au(0),电位法指示终点以计算金的质量分数。
试剂
除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。
盐酸(ρ=1.19g/mL)。
硝酸(ρ=1.42g/mL)。
硫酸(ρ=1.84g/mL)。
磷酸(ρ=1.70g/mL)。
硫酸与磷酸混合酸: 取50mL磷酸于300mL烧杯中,边搅拌边缓慢加入50mL硫酸,混匀,冷却,移入试剂瓶中备用。
氯化钠溶液(250g/L)。
硫酸溶液(4+96)。
硫酸亚铁标准滴定溶液(0.008mol/L):
a) 配制: 称取10.5g硫酸亚铁(FeSO4·7H2O)固体,溶于盛有5000mL硫酸溶液的棕色玻璃瓶中,混匀,放置7d以上标定。
b) 标定: 标定与试料的测定平行进行。
移取10.00mL金标准溶液置于100mL烧杯中,加入0.5mL 氯化钠溶液,水浴蒸至湿盐状,取下。加入5mL硫酸与磷酸混合酸,加入水至40mL体积。于溶液中插入铂指示电极和饱和KCl甘汞参比电极,于电磁搅拌下,用硫酸亚铁标准滴定溶液滴定至近终点时(即电位突跃值变化较大时),再用微量滴定管滴定至电位突跃点为终点。
平行标定三份,所消耗硫酸亚铁标准滴定溶液体积的极差不应超过0.020mL,取其平均值。
按式(1)计算硫酸亚铁标准滴定溶液的实际浓度:
式中:
c ——硫酸亚铁标准滴定溶液的实际浓度,单位为摩尔每升(mol/L);
3 ——硫酸亚铁标准滴定溶液将Au(Ⅲ)滴定至Au(0)时电子转移的数;
ρ0——移取金标准溶液的质量浓度,单位为毫克每毫升(mg/mL);
V1——移取金标准溶液的体积,单位为毫升(mL);
V2——标定中所消耗的硫酸亚铁标准滴定溶液的体积,单位为毫升(mL);
196.966——金的摩尔质量,单位为克每摩尔(g/mol)。
金标准溶液: 称取0.5000g金属金(质量分数不小于99.99%),精确至0.0001g。 置于400mL烧杯中,加入12mL盐酸、3mL硝酸,盖上表面皿,水浴加热至*溶解,取下。用少量水冲洗表面皿及烧杯壁,加入5.0mL氯化钠溶液,水浴蒸至湿盐状,取下。加入4mL盐酸,用少量水冲洗烧杯壁,水浴蒸至湿盐状,反复四次,取下。加入100mL盐酸,移入500mL容量瓶中,用水稀释至刻度。混匀。此溶液1mL含1mg金。
仪器
电位仪,最小电位检出精确度不大于1mV。
指示电极: 铂电极。
参比电极: 饱和KCl甘汞电极。
微量滴定管: 最小刻度0.005mL。
试样
试样粒度应不大于0.095mm。
试验步骤
试料
称取试样0.20g,精确至0.0001g。
平行试验
平行做两份试验,取其平均值。
空白试验
随同试料做空白试验。
测定
将试料置于200mL烧杯中,以少许水润湿,加入15mL盐酸、5mL硝酸,盖上表皿,低温加热溶解至不溶渣为白 色。取下,冷却至室温,将试液移入50mL容量瓶中,用水稀释至刻度。混匀。
移取10.00mL上述试液于100mL烧杯中,加入1.0mL氯化钠溶液,水浴蒸至湿盐状,加入4mL盐酸,用少量水冲洗烧杯壁,水浴蒸至湿盐状,反复4次,取下。
加入5mL硫酸与磷酸混合酸,加入水至40mL体积。于试液中插入铂指示电极和饱和KCl甘汞参比电极,于电磁搅拌下,用硫酸亚铁标准滴定溶液滴定至近终点时(即电位突跃值变化较大时),再用微量滴定管滴定至电位突跃点为终点。
试验数据处理
金含量以金的质量分数ωAu计,按式(2)计算: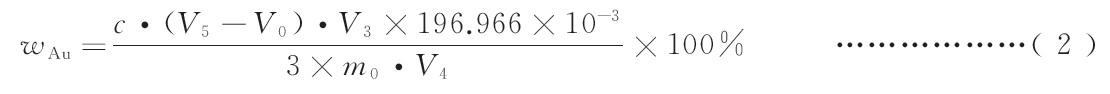
式中:
c ——硫酸亚铁标准滴定溶液的实际浓度,单位为摩尔每升(mol/L);
V5——滴定试液所消耗的硫酸亚铁标准滴定溶液的体积,单位为毫升(mL);
V0——滴定空白所消耗的硫酸亚铁标准滴定溶液的体积,单位为毫升(mL);
V3——试液的总体积,单位为毫升(mL);
196.966——金的摩尔质量,单位为克每摩尔(g/mol);
3 ——硫酸亚铁标准滴定溶液将Au(Ⅲ)滴定至Au(0)时电子转移的数;
m0——试料的质量,单位为克(g);
V4——分取试液的体积,单位为毫升(mL)。
计算结果表示到小数点后两位。